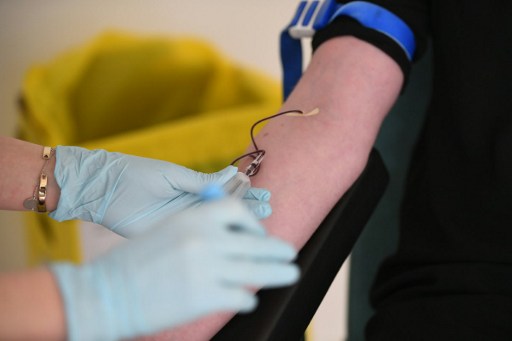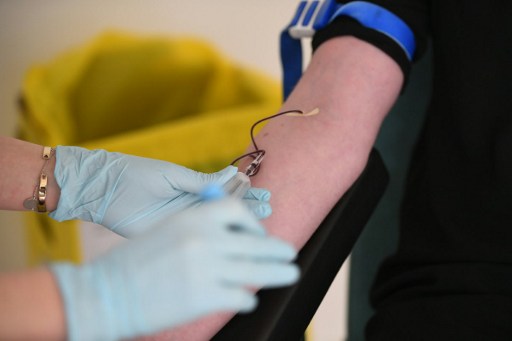
Rennes, France | AFP | samedi 06/01/2017 - "Visitor". Dans les locaux vitrés de Biotrial à Rennes, le badge en anglais rappelle au visiteur qu'il pénètre dans un centre d'essais cliniques international dont 90% des clients sont étrangers. Mais un an après l'accident mortel, dans les dortoirs, les volontaires se font rares.
L'accident, "c'est quelque chose qui est tout le temps dans les conversations", reconnaît Pascale Guezelou, infirmière et coordinatrice de l'unité clinique, visiblement ébranlée. Elle qui exerce depuis des années chez Biotrial dans le but "d'apporter une amélioration dans la vie des patients" peine toujours à comprendre comment cela a pu arriver alors qu'"on a une réglementation très sévère" qu'"on applique à la lettre".
L'affaire commence le soir du 10 janvier 2016. Cinq jours après avoir débuté l'essai clinique du BIA 10-2474, une molécule du laboratoire portugais Bial censée soulager douleur et anxiété, Guillaume Molinet, un volontaire de 49 ans, se plaint de maux de tête et de troubles de la vue. Il quitte Biotrial pour être hospitalisé au CHU voisin.
Le lendemain matin, les cinq autres volontaires participant à l'essai reçoivent leur sixième dose. Au même moment, l'état de Guillaume Molinet s'aggrave. Le premier diagnostic du CHU évoque un accident vasculaire cérébral (AVC). Aucun lien n'est fait avec la molécule mais Biotrial par précaution décide d'interrompre l'essai.
Guillaume Molinet décède le 17 janvier. Entretemps, les autres volontaires, dont quatre connaissent aussi des troubles, sont hospitalisés.
C'est un accident inédit en France. Sur les 100.000 volontaires à qui on administre des molécules dans le monde, seuls 40 font l'objet d'une hospitalisation chaque année, et dans 75% des cas, elle n'est pas due aux effets du produit.
On apprendra que la victime n'est pas décédée d'un AVC usuel, mais de lésions vasculaires atypiques avec des micro-hémorragies au niveau cérébral, liées à l'administration de la molécule de Bial. Surtout, on découvre à l'autopsie que le défunt était porteur d'une pathologie préexistante dite "occulte" -qui ne pouvait être détectée que post-mortem- et qui a favorisé l'étendue des lésions cérébrales.
- 'Trois quarts des contrats ont disparu' -
"Quelles que soient les circulaires ministérielles, quelles que soient les IRM ou les autres examens biologiques, nous n'aurions pu détecter cette anomalie endocrânienne", se défend aujourd'hui le président de Biotrial Jean-Marc Gandon.
Le laboratoire pharmaceutique portugais Bial a depuis ces événements définitivement abandonné les recherches sur la molécule en cause.
Le centre d'essai rennais (140 lits et une base de 56.000 volontaires), qui a suspendu quelques semaines plus tard un nouvel essai clinique portant sur un autre médicament, a été pointé du doigt par la ministre de la Santé Marisol Touraine, s'appuyant sur un rapport de l'Inspection générale des affaires sociales (IGAS), qui lui a reproché "trois manquements majeurs": sa rapidité à réagir et son manque de communication.
"Trois quarts des contrats ont disparu en 15 jours", raconte à l'AFP Jean-Marc Gandon. Sur les 60 études de phase 1 -ces essais essentiels durant lesquels les molécules sont testées sur l'homme- qui étaient programmées en 2016, "on en a fait six", résume ce pharmacien qui a fondé Biotrial en 1989.
De son côté, l'Agence du médicament (ANSM) a assuré que la composition du produit testé répondait aux "exigences attendues", mais ce rapport est régulièrement remis en question par des médias.
- 'le risque zéro n'existe pas' -
Aujourd'hui chez Biotrial (250 salariés dont 180 à Rennes) l'activité de phase 1 ne représente plus que 4% de son chiffre d'affaires, contre 40% auparavant. Selon Jean-Marc Gandon, les volontaires sont toujours aussi nombreux à se présenter, mais les clients ont préféré quitter la France, dissuadés par les "lourdeurs réglementaires".
Et depuis "l'accident", la réglementation française a encore allongé les délais pour lancer une étude, décourageant d'autant plus les laboratoires.
Si à 54 ans, Jean-Marc Gandon garde l'espoir de relancer la phase 1 à Rennes, il a surtout pour ambition de renforcer son ancrage à l'étranger: les essais cliniques de son centre de Newark, près de New York, inauguré en septembre, ont très bien démarré et il envisage désormais de s'aventurer en Asie.
En France, le parquet de Paris a ouvert mi-juin une information judiciaire contre X pour "homicide involontaire" sur les circonstances du décès ainsi que pour "blessures involontaires" pour quatre des participants à l'essai qui présentaient des lésions cérébrales.
Malgré ces événements, David Damiens, volontaire depuis cinq ans, a choisi de ne pas retirer sa confiance à Biotrial. "Le risque zéro n'existe pas", résume cet homme de 45 ans. "J'ai été militaire pendant neuf ans. Quand j'ai signé, je savais les risques que je prenais". Pour lui, qui a participé à 11 études chez Biotrial, ces essais, outre un apport financier, c'est sa "façon d'aider la médecine".
L'accident, "c'est quelque chose qui est tout le temps dans les conversations", reconnaît Pascale Guezelou, infirmière et coordinatrice de l'unité clinique, visiblement ébranlée. Elle qui exerce depuis des années chez Biotrial dans le but "d'apporter une amélioration dans la vie des patients" peine toujours à comprendre comment cela a pu arriver alors qu'"on a une réglementation très sévère" qu'"on applique à la lettre".
L'affaire commence le soir du 10 janvier 2016. Cinq jours après avoir débuté l'essai clinique du BIA 10-2474, une molécule du laboratoire portugais Bial censée soulager douleur et anxiété, Guillaume Molinet, un volontaire de 49 ans, se plaint de maux de tête et de troubles de la vue. Il quitte Biotrial pour être hospitalisé au CHU voisin.
Le lendemain matin, les cinq autres volontaires participant à l'essai reçoivent leur sixième dose. Au même moment, l'état de Guillaume Molinet s'aggrave. Le premier diagnostic du CHU évoque un accident vasculaire cérébral (AVC). Aucun lien n'est fait avec la molécule mais Biotrial par précaution décide d'interrompre l'essai.
Guillaume Molinet décède le 17 janvier. Entretemps, les autres volontaires, dont quatre connaissent aussi des troubles, sont hospitalisés.
C'est un accident inédit en France. Sur les 100.000 volontaires à qui on administre des molécules dans le monde, seuls 40 font l'objet d'une hospitalisation chaque année, et dans 75% des cas, elle n'est pas due aux effets du produit.
On apprendra que la victime n'est pas décédée d'un AVC usuel, mais de lésions vasculaires atypiques avec des micro-hémorragies au niveau cérébral, liées à l'administration de la molécule de Bial. Surtout, on découvre à l'autopsie que le défunt était porteur d'une pathologie préexistante dite "occulte" -qui ne pouvait être détectée que post-mortem- et qui a favorisé l'étendue des lésions cérébrales.
- 'Trois quarts des contrats ont disparu' -
"Quelles que soient les circulaires ministérielles, quelles que soient les IRM ou les autres examens biologiques, nous n'aurions pu détecter cette anomalie endocrânienne", se défend aujourd'hui le président de Biotrial Jean-Marc Gandon.
Le laboratoire pharmaceutique portugais Bial a depuis ces événements définitivement abandonné les recherches sur la molécule en cause.
Le centre d'essai rennais (140 lits et une base de 56.000 volontaires), qui a suspendu quelques semaines plus tard un nouvel essai clinique portant sur un autre médicament, a été pointé du doigt par la ministre de la Santé Marisol Touraine, s'appuyant sur un rapport de l'Inspection générale des affaires sociales (IGAS), qui lui a reproché "trois manquements majeurs": sa rapidité à réagir et son manque de communication.
"Trois quarts des contrats ont disparu en 15 jours", raconte à l'AFP Jean-Marc Gandon. Sur les 60 études de phase 1 -ces essais essentiels durant lesquels les molécules sont testées sur l'homme- qui étaient programmées en 2016, "on en a fait six", résume ce pharmacien qui a fondé Biotrial en 1989.
De son côté, l'Agence du médicament (ANSM) a assuré que la composition du produit testé répondait aux "exigences attendues", mais ce rapport est régulièrement remis en question par des médias.
- 'le risque zéro n'existe pas' -
Aujourd'hui chez Biotrial (250 salariés dont 180 à Rennes) l'activité de phase 1 ne représente plus que 4% de son chiffre d'affaires, contre 40% auparavant. Selon Jean-Marc Gandon, les volontaires sont toujours aussi nombreux à se présenter, mais les clients ont préféré quitter la France, dissuadés par les "lourdeurs réglementaires".
Et depuis "l'accident", la réglementation française a encore allongé les délais pour lancer une étude, décourageant d'autant plus les laboratoires.
Si à 54 ans, Jean-Marc Gandon garde l'espoir de relancer la phase 1 à Rennes, il a surtout pour ambition de renforcer son ancrage à l'étranger: les essais cliniques de son centre de Newark, près de New York, inauguré en septembre, ont très bien démarré et il envisage désormais de s'aventurer en Asie.
En France, le parquet de Paris a ouvert mi-juin une information judiciaire contre X pour "homicide involontaire" sur les circonstances du décès ainsi que pour "blessures involontaires" pour quatre des participants à l'essai qui présentaient des lésions cérébrales.
Malgré ces événements, David Damiens, volontaire depuis cinq ans, a choisi de ne pas retirer sa confiance à Biotrial. "Le risque zéro n'existe pas", résume cet homme de 45 ans. "J'ai été militaire pendant neuf ans. Quand j'ai signé, je savais les risques que je prenais". Pour lui, qui a participé à 11 études chez Biotrial, ces essais, outre un apport financier, c'est sa "façon d'aider la médecine".